
手机扫码访问本站

微信咨询
2019年3月,全球首仿帕纳替尼——格列卫、尼罗替尼、达沙替尼耐药后的三代白血病靶向药,且是全球唯一一个可以抑制ABL-T315I突变的药物。
帕纳替尼是一种三代TKI,初始检测其挽救对前线药物耐药患者的疗效,对ABL的Thr315Ile突变患者尤其有效,而且抗其它激酶,比如FLT3,FGFR,KIT,PDGFR,VEGFR和SRC。在大型PACE试验中,帕纳替尼治疗多重耐药慢性粒细胞白血病和Ph+急性淋巴细胞白血病有效,慢性期疾病的主要终点——主要细胞遗传学缓解发生于60%的患者,其中80%达到长期持久缓解。根据这些结果,帕纳替尼开始作为一线方案在临床试验中评估:EPIC研究比较了随机分配帕纳替尼45 mg/天vs标准剂量伊马替尼的疗效。
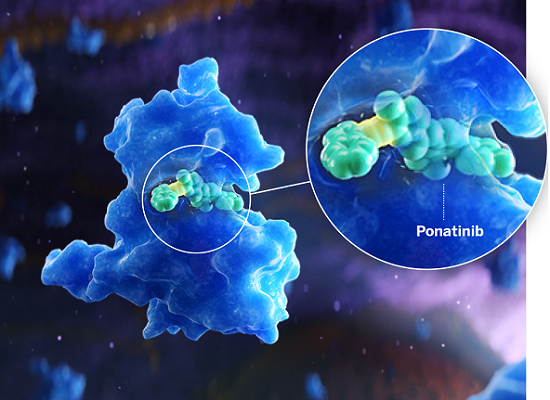
Ponatinib是一种激酶抑制剂。 Ponatinib在体外抑制ABL和T315I突变体ABL 酪氨酸激酶的活性有IC50浓度分别为0.4和2.0 nM。Ponatinib抑制另外的激酶在体外的活性有IC50浓度0.1和20 nM间,包括VEGFR, PDGFR, FGFR,EPH受体和激酶的SRC家族,和KIT, RET, TIE2, 和FLT3的成员。Ponatinib在体外抑制表达天然 或突变体BCR-ABL,包括T315I细胞的生存能力。在小鼠中,用ponatinib治疗当与对照比较时减低表达天然或T315I突变体BCR ABL肿瘤的大小。
帕纳替尼(Ponatinib)可治两类白血病 美国食品药品监督管理局(FDA)批准帕纳替尼(Iclusig)治疗有慢性粒性白血病(CML)和Philadelphia染色体阳性急性淋巴母细胞白血病(Ph+ALL),两种罕见血和骨髓疾病的成年人,帕纳替尼(Iclusig)提前三个多月通过审评。帕纳替尼(Iclusig)阻断促进癌细胞发展某些蛋白。药物每天服用1次治疗有CML和Ph+ALL的慢性,加速,和母细胞相患者其白血病是对一类被称为酪氨酸激酶抑制剂(TKIs)耐药或不能耐受。帕纳替尼(Iclusig)靶向CML细胞有一种特殊突变,被称为T315I,它使这些细胞对当前批准的TKIs耐药。帕纳替尼(Iclusig)的批准是重要的因为对其他药物不反应的CML患者提供治疗选择,尤其是有T315I突变很少治疗选择的患者。帕纳替尼(Iclusig)是2012年底被批准治疗CML的第三个药物和治疗ALL的第二个药物。
2012年9月FDA批准Bosulif(bosutinib)和2012年10月批准Synribo(omacetaxine mepesuccinate)治疗各种相的CML。2012年8月批准Marqibo(硫酸长春新碱[vincristine sulfate]脂质体注射液)治疗Philadelphia染色体阴性ALL。帕纳替尼(Iclusig)在监管局加速批准程序下,该程序提供患者较早得到有前途新药而公司进行另外研究确证药物的获益和安全使用。治疗被赋予孤儿药物指定因为意向治疗一种罕见病或情况。在449例有各种CML和Ph+ALL相患者一项单组临床试验评价帕纳替尼(Iclusig)的安全性和有效性。通过在大多数CML患者发现的表达Philadelphia染色体遗传突变细胞百分率减低,重大细胞遗传学反应(MCyR)证实药物的有效性。所有患者的54%和70%患者有T315I突变实现MCyR。在分析时尚未达到MCyR的中位时间。
在CML和Ph+ ALL加速和母细胞相,通过经历白细胞计数正常化或无白血病证据(重大血液学反应或MaHR)患者数确定Iclusig的有效性。结果显示:有CML加速相患者52% 经历MaHR中位时间9.5个月;有母细胞相CML患者31%实现MaHR中位时间4.7个月;和有Ph+ALL患者41%实现MaHR中位时间3.2个月。帕纳替尼(Iclusig)正在被批准有一个黑框警告警告患者和卫生保健专业人员药物可能致血液凝固和肝脏毒性。
临床试验期间最常报道副作用包括高血压,皮疹,腹痛,疲乏,头痛,干皮肤,便秘,发热,关节痛,和恶心。帕纳替尼(Iclusig)是由在麻省剑桥的ARIAD药业上市,Bosulif是由位于纽约城的Pfizer上市,和Synribo是由位于滨州的Frazer,Teva药业上市。