
手机扫码访问本站

微信咨询
2-脱氧核糖分子式C4H9O3CHO。2-脱氧核糖是核糖的一个2-位羟基被氢取代的衍生物,在细胞核中作为脱氧核糖核酸DNA的组分,十分重要;最早由胸腺核苷中析离得到。α-D-2-脱氧核呋喃糖的熔点78~82℃,比旋光度[α]D-55°;β-异构体熔点96~98℃,[α]D-91°→-58°。D-2-脱氧核糖与苯胺形成结晶的半缩醛胺,熔点175~177℃,[α]D+46°,常用于D-2-脱氧核糖的分离提纯和贮存,需要时将半缩醛胺与苯甲醛反应,即得2-脱氧核糖。2-脱氧核糖可进行多种特殊颜色反应,并可进行定量测定。常用的方法是2-脱氧核糖在硫酸和乙酸存在下与二苯胺反应得蓝色,与硫酸亚铁反应也得蓝色,称为凯勒-基连尼反应。D-2-脱氧核糖甚易与乙醇-HCl作用形成糖苷,这种糖苷甚易水解。脱氧核糖的合成方法有多种,收率为5%~10%。
方法1:
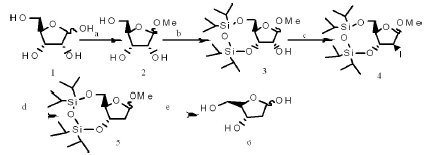
1)酸性树脂(10-20%w/w),甲醇,4℃过夜反应b)1,3-二氯-1,1,3,3-四异丙基二硅氧烷吡啶室温反应一小时c)三苯基磷,咪唑,碘,甲苯回流8小时d)三乙胺甲醇Pd/C在饱和氢气中反应24小时。0℃下,在100ml的烧瓶中加入3g化合物1D-核糖,同时加入50ml无水甲醇和酸性树脂(10-20%w/w)充分搅拌溶解。然后将温度上升到4℃下反应过夜。利用TLC跟踪,反应完全后,抽滤旋干,得到无色油状液体,产率为100%。1HNMR(400MHz,CDCl3):δ=3.25(s,3H,OCH3),3.46(dd,JH,H=6.4,12.5Hz,1H,5-H),3.65(dd,JH,H=3.1,12.5Hz,1H,5-H),3.83-3.89(m,2H,3-H,4-H),4.01(dd,JH,H=4.8,7.0Hz,1H,2-H),4.75(s,1H,1-H)ppm.
2)室温下,将产物2(1.5709g,9.58mmol)放入25ml的烧瓶中,加入10ml的吡啶充分溶解,然后在冰水浴下缓慢滴加3.67ml(1.2eq,11.49mmol)1,3二氯-1,1,3,3-四异丙基二硅氧烷,充分搅拌后放入室温反应,利用TLC跟踪反应,2小时后,反应完全,加入300ml乙酸乙酯,每次用50ml水萃取,重复六次,再用50ml饱和碳酸氢钠萃取,重复两遍。最后合并有机相,加入无水硫酸钠干燥,抽滤,减压旋干。硅胶柱层析(EA:PE=1:9Rf=0.5)得到2.73g无色油状物,产率为81.5%。1HNMR(400MHz,CDCl3):δ=1.03-1.11(m,28H,TIPS),3.33(s,3H,OCH3),3.71-3.79(m,1H,5-H),3.99-4.12(m,3H,5-H,2-H,4-H),4.49-4.52(m,1H,3-H),4.83(s,1H,1-H)ppm.
3)室温下,将化合物3(2.0000g,5.1151mmol)放入100ml的烧瓶中同时加入三苯基膦(6.444g,15.3453mmol),咪唑(1.6707g,15.3453mmol)溶于40ml甲苯,100℃下将其溶解,完全溶解后加入碘单质(6.4961,25.5755mmol),将温度升温至回流温度,八小时后,TLC跟踪反应显示反应完全,先加入10ml饱和碳酸氢钾猝灭反应至无气泡产生,后加入200ml乙酸乙酯用水萃取三次,最后用饱和氯化钠萃取一次。合并有机相加入无水硫酸钠,抽滤旋干。1HNMR(400MHz,CDCl3):δ=1.01-1.16(m,28H,TIPS),3.36(s,3H,OCH3),3.77-3.83(m,1H,5-H),3.90-3.95(m,1H,2-H),3.98-4.01(m,1H,5-H,),3.09-4.12(m,1H,4-H)4.63-4.67(m,1H,3-H),4.74-4.73(s,1H,1-H)ppm.13CNMR(75MHz,CDCl3):δ=12.4-16.6,55.4,102.96,83.71,81.85,66.29,55.44,29.49,17.55,17.49,17.39,17.24,16.99,16.96,13.59,13.36,12.84,12.44ppm.HR-MS(ESI+):539.1116[M+Na](calcd.forC18H37IO5Si2Na:539.1116).
4)室温下,将化合物4放入25ml烧瓶中,加入10ml无水甲醇4ml三乙胺802.4mg 10%Pd/C在饱和氢气状态反应,24小时后点板,反应完全抽滤旋干,硅胶柱层析(EA:PE=1:100)得到1.35mg无色油状物,化合物3和化合物4两步收率55%。1HNMR(400MHz,CDCl3):δ=0.98-1.06(m,28H,TIPS),1.98-2.05(m,1H,2-H),2.13-2.28(m,1H,2-H),3.36(s,3H,OCH3),3.64-3.69(m,1H,5-H,),3.78-3.83(m,1H,5-H),3.93-3.97(s,1H,4-H),4.54-4.59(s,1H,3-H),4.85-4.86(s,1H,1-H)ppm.13CNMR(75MHz,CDCl3):103.93,84.84,74.21,66.41,54.49,42.05,31.51,30.21,29.70,17.59,17.44,17.28,17.10,16.97,13.39,12.88,12.57 ppm.HR-MS(ESI+):451.21780[M+HCOO](calcd.forC18H38O6Si2HCOO:451.21780).
5)室温下,将化合物5(90.4mg,0.2407mmol)放入10ml的烧瓶中,加入1.5ml1mol/L的H2SO4(水:甲醇:EA=1:1:1)室温反应4小时后,用碳酸钡猝灭反应,抽滤旋干,硅胶柱层析(EA:乙醇=5:1)得到白色固体28.1mg,收率为93.6%。[α]25D-47°(H2O)1HNMR(400MHz,D2O)δ=1.3-2.0(m1.3H),2.17-2.28(m,4.8H),2.4(s,0.6H),2.42-2.51(m,1.2H),2.62-2.6(m,0.3H),2.83-2.91(m,0.3H),3.38-3.41(m,0.6H),3.62-4.04(m,2.8H),4.15-4.22(m,4H),4.30-4.35(m,4H),4.41-4.45(m,1H),4.85-4.87(m,2H),5.62-5.68(m,3H)ppm;13CNMR(400MHz,D2O)98.2,97.9,94.1,91.6,86.4,85.6,73.1,71.2,71.4,69.8,69.2,68.5,67.6,67.4,67.3,66.5,66.3,64.7,63.0,62.5,61.2,415,41.1,33.7,33.1ppm;
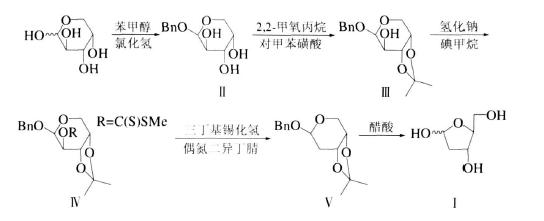
方法2:
1)苄基-3,4-O-异丙叉基-β-L-阿拉伯吡喃糖苷(Ⅲ)的制备
0℃时将氯化氢气体通入25mL苯甲醇中至饱和,静置40min后,称取L-阿拉伯糖(5g,33mmol)加入反应液中,室温搅拌10h,其间有白色固体物缓慢析出。加入37.5mL乙酸乙酯使固体沉淀完全,过滤,用乙酸乙酯洗涤,干燥,得7.8g白色固体产物Ⅱ:263.0(M+Na+),503.0(2M+Na+)。不需纯化可直接进行下步反应。上步产物Ⅱ(28g,120mmol)和2,2-二甲氧丙烷(50mL,41mmol)溶于丙酮(315mL)中,另称取对甲苯磺酸(p-TsOH·H2O)0.635g(4mmol)加入反应物中,室温搅拌2h,然后滴加三乙胺至中性,减压蒸馏得到29.4g黄色液态产物Ⅲ,硅胶柱层析分离,用V(正己烷)∶V(乙酸乙酯)=3∶1洗脱,得无色液体,产率98%。从L-阿拉伯糖到产物Ⅲ的产率为90%。1HNMR(CDCl3)δ:7.41~7.21(m,5H,C6H5),4.73(d,J=11.8Hz,1H,OH),4.25~4.10(m,2H,CH2),3.85(s,2H,CH),3.77~3.68(m,1H,CH),2.40(d,J=6.7Hz,1H,CH),1.53(s,3H,CH3),1.33(s,3H,CH3);303.0(M+Na+),583.0(2M+Na+)。以上数据符合产物结构特征。
2)苄基-3,4-O-异丙叉基-2-O-[(亚甲基)硫代酰基]-β-L-阿拉伯吡喃糖苷(Ⅳ)的制备
将化合物Ⅲ(4.27g,16mmol)溶于50mL无水THF中,搅拌,于0℃慢慢加入NaH(0.61g,16mmol),当初始反应由剧烈到减缓,移去冰浴,室温下继续搅拌30min,快速加入二硫化碳(1.83mL,30mmol),继续搅拌30min,而后在室温下缓慢滴加CH3I(1.90mL,30mmol),继续搅拌30min,加入5mL水,减压蒸馏至溶液体积减少一半,水相用乙酸乙酯萃取3次,有机相用盐水洗涤,无水硫酸镁干燥,过滤,浓缩得4.97g黄色浆状产物Ⅳ,产率88%,不必进一步纯化1HNMR(CDCl3)δ:7.38~7.20(m,5H,C6H5),5.75(dd,J=11.3Hz,J=1.3Hz,1H,OH),5.18(d,J=6.3Hz,1H,CH),4.50(dd,J=11.3Hz,J=1.3Hz,1H,CH),4.30~4.21(m,1H,CH),4.00~3.95(m,2H,CH2),2.58(s,3H,CH3),1.55(s,3H,CH3),1.39(s,3H,CH3);393.0(M+Na+)。以上数据符合产物结构特征。
3)苄基-2-脱氧-β-L-赤型吡喃糖苷(Ⅴ)的制备
将上步得到的Ⅳ(2g,5.5mmol)加入50mL无水甲苯中,加热至回流,同时通氮气保护。另外将三丁基锡化氢(2.19mL,8mmol)和偶氮二异丁腈(0.09g,0.54mmol)加入到10mL无水甲苯中制成溶液,再将其慢慢滴入反应溶液,滴毕,另称取0.09g偶氮二异丁腈溶于10mL甲苯中,同样缓慢滴入反应液中,继续搅拌30min。减压蒸馏浓缩,再用w(NaOH)=5%的水溶液洗涤,加入无水硫酸镁干燥,过滤,真空浓缩得产品和苯酚的混合物。用硅胶柱层析分离,以V(正己烷)∶V(乙酸乙酯)=12∶1洗脱,得0.78g产物Ⅴ,产率55%:1HNMR(CDCl3)δ:7.40~7.21(m,5H,C6H5),5.73(dd,J=11.3Hz,J=1.4Hz,1H,OH),5.00(d,J=6.3Hz,1H,CH),4.53(dd,J=11.3Hz,J=1.3Hz,1H,CH),4.30~4.25(m,1H,CH),4.05~4.00(m,2H,CH2),1.53(s,3H,CH3),1.42(s,3H,CH3);287.0(M+Na+)。以上数据符合产物结构特征。
4)2-脱氧-L-核糖(Ⅰ)的制备
将产物Ⅴ(73g,0.28mol)加入到350mLw(醋酸)=80%的水溶液中,室温搅拌18h,加入三乙胺中和后将混合物转移到分液漏斗中,用乙酸乙酯洗涤(3×500mL),将水相蒸干,剩余液体用乙醇和甲苯共蒸两次,用硅胶柱层析分离,以V(正己烷)∶V(乙酸乙酯)=12∶1洗脱,得34g产品Ⅰ,本步产率92%,从L-阿拉伯糖到Ⅰ的总产率为40%。157.2(M+Na+);元素分析结果:实测值(理论值)/%,w(C)=43.97(43.87),w(H)=7.24(7.26);[α]D+55°(c0.27,水),以上数据符合产物结构特征。
[1] 中国大百科全书(化学卷)
[2] 2-脱氧-D核糖的新合成方法研究
[3] 2-脱氧-L-核糖的合成方法改进