
手机扫码访问本站

微信咨询
乙肝病毒不断蔓延,感染HIV的人数不断增加,据世界卫生组织统计,全世界约有3.5亿乙型肝炎病毒(HBV)携带者,占全球人口的5%以上;全球艾滋病患者已超过6500万人。目前使用的抗病毒药物近50%是核苷类药物,近几年有不少疗效较好的核苷类抗病毒药物上市,但由于耐药现象不断出现,迫切需要开发出新的抗病毒药物。恩曲他滨(emtricitabine,FTC)为一种新型的核苷类逆转录酶抑制剂,其化学结构与目前临床上广泛使用的其他核苷类似物不同之处在于其5-碳位置上的氟基,作用机制类似于拉米夫定(lamivudine,3TC),较拉米夫定血浆半衰期更长,抗病毒活性更好。2003年7月2日得到美国FDA批准在美国上市,商品名为Emtriva。体内外研究表明恩曲他滨具有以下几点:(1)抗病毒活性高,其抗病毒活性是拉米夫定的4~10倍;(2)有较好药动学特性,可以每天给药1次,使患者有更好的依从性;(3)恩曲他滨的毒性较小,安全性高,其IC50值比齐多夫定低95倍;(4)可以液体形式服用,特别适合于儿童。由于恩曲他滨在细胞系统内表现出良好的药动学特性及低毒性,被视为抗HIV和HBV的潜在良药。
恩曲他滨为化学合成类核苷胞嘧啶,其抗HIV-1的机制是通过多步磷酸化形成具有细胞活性5’-三磷酸盐,5’-三磷酸盐通过与天然的5-磷酸胞嘧啶竞争性地渗入到病毒DNA合成的过程中,最终导致其DNA链断裂,从而竞争性地抑制HIV-1逆转录酶和HBV-DNA聚合酶活性。研究显示恩曲他滨具有对HIV-1、HIV-2和HBV特异性的抗病毒活性,其抗病毒活性是拉米夫定的4~10倍,临床实验结果表明,恩曲他滨用于HIV感染患者,有显著的病毒抑制作用,用于乙型肝炎治疗,能降低慢性感染病人的乙肝病毒水平。
国内Ⅰ期临床试验结果表明,20例健康男性受试者口服单剂量200mg恩曲他滨后,吸收迅速,约1h血药达峰值,体内消除符合线性动力学模型,个体差异较小,Cmax为(2.4±0.6)mg·L-1,Tmax为(1.0±0.4)h,AUC0~14h为(9.2±1.4)mg·h·L-1,t1/2为(3.1±0.3)h,与国外文献报道基本一致,恩曲他滨可空腹服用或与食物同服,与食物同服时其AUC不变,Cmax下降29%。恩曲他滨在体内拌硫醇氧化成3’-亚砜的非对应异构体,或与葡萄糖醛酸结合生成2’-氧葡糖苷酸,主要通过肾小球滤过和肾小管的主动分泌排出,可能与其它通过肾清除的成分竞争消除。恩曲他滨与拉米夫定性质相似,但恩曲他滨有更长的生物半衰期,可以每天给药1次,使患者有更好的依从性。
1.与其他抗病毒药物和用于成人HIV-1感染的治疗;
2.用于慢性乙型肝炎的治疗。
成人口服一日一次,一次0.2g,可与食物同服。
临床应用中,接受恩曲他滨和其它抗病毒药物治疗,最常见的不良反应有头痛,腹泻,恶心和皮疹,程度从轻到中等严重,约1%病人因以上原因中止服药,所有不良反应发生频率与对照组相当,但皮肤色素沉着在恩曲他滨组略高,皮肤色素沉着以出现于手掌和/或足底明显,一般较轻,且不伴其他症状。
恩曲他滨经肾脏排泄,肾功能损害病人酌情减量,由于恩曲他滨并不能阻止HIV感染可能,避免任何导致HIV感染的行为。
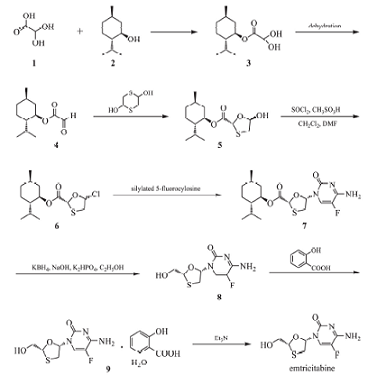
1)二羟基乙酸-L-薄荷酯(3)的制备
在装有搅拌器、温度计、分水器的1L反应瓶中依次加入正己烷340mL、一水合乙醛酸40g(0.435mol)、薄荷脑102g(0.653mol)、硫酸1.2g,加热至65~75℃,回流2h(大约分水25~29mL)。降温至45~50℃,加水100mL,搅拌10min,静置,分出有机层,向有机层中加入纯化水100mL,用0.48mol·L-1碳酸氢钠溶液调pH至5.0。搅拌10min,静置20min,保留有机层。向有机层中加入纯化水750mL、亚硫酸氢钠29.6g,搅拌至溶液澄清,室温搅拌18h。静置20min,保留水层。向水层中加入正己烷50mL,搅拌10min,静置20min,保留水层。将水层用饱和碳酸氢钠溶液调pH至5.0,向其中加入甲醛32.6g,室温搅拌18h(有类白色固体析出)。抽滤,水洗滤饼,干燥,得到白色粉末状固体(3)79.7g,收率79.6%,mp74~82℃,纯度95%,[α]20D=-73.6°(c3.7,EtOH)。
2)(2R,5R)-5-羟基-1,3-氧硫杂环戊烷-2-羧酸-L-薄荷酯(5)的制备
向反应瓶中依次加入甲苯396mL、冰醋酸7.9mL,搅拌加入水合(3)79.7g(0.346mol),加热至95~113℃,开始回流分水至不出馏。在109~113℃,常压蒸馏甲苯105~110mL。将物料降温至20~30℃,加入2,5-二羟基-1,4-二噻烷25.5g(0.167mol),加热升温至80℃,回流反应2h。反应液降温至20~30℃过滤,将滤液降温至0~5℃,向其中滴加三乙胺(4.8mL)和石油醚(484mL)的混合液,滴加完毕,反应液在0~5℃保温搅拌8h。抽滤,用0~5℃甲苯(165mL)和石油醚(495mL)的混合溶液洗涤滤饼,于35~45℃真空干燥3~5h,得到环合物干品(5)85.1g,收率85.3%,mp98~100℃,[α]20D=-71.3°(c3.7,EtOH)。IR(KBr)σ:1732(CO)、3470(-OH)cm-1。
3)(2R)-5-氯-1,3-氧硫杂环戊烷-2-羧酸-L-薄荷酯(6)的制备
在反应瓶中加入二氯甲烷1000mL,搅拌下依次加入环合物(5)100g(0.347mol)、甲磺酸0.23mL、N,N-二甲基甲酰胺50mL,溶解后冷却至(7±2)℃,滴加氯化亚砜30.27mL(0.417mol),在10~15℃下搅拌反应1.5h。常压下蒸馏,收集590mL蒸馏物(6),剩余溶液冷却至20~25℃,收率87.6%。
4)硅烷化5-氟胞嘧啶的制备
将81mL(0.386mol)六甲基二硅胺烷加入1000mL四口瓶中,用80mL二氯甲烷洗涤加料漏斗及量筒。搅拌下加入44.83g(0.347mol)5-氟胞嘧啶,用20mL二氯甲烷冲洗漏斗。用移液管量取0.4mL甲磺酸,加入反应瓶中,加热升温至外浴60℃,回流7h。溶液变澄清后向反应液中加入55mL(0.397mol)三乙胺,所得溶液备用。
5)5(2R,5S)-(5-氟胞嘧啶-1-基)-1,3-氧硫杂环戊烷-2-羧酸-L-薄荷酯(7)的制备
向上述得到的硅烷化5-氟胞嘧啶反应液中滴加(2R)-5-氯-1,3-氧硫杂环戊烷2-羧酸-L-薄荷酯,温度控制在40~45℃,加毕,混合物在40~45℃下回流6h。冷至室温,在另一个反应瓶中加入600mL二氯甲烷及1000mL水,搅拌下缓慢加入反应液后继续搅拌1h。分液,水洗(1000mL×3),常压蒸除二氯甲烷至近干,加入500mL乙酸乙酯继续蒸馏,蒸至残余物呈黄色黏稠状。加入400mL乙酸乙酯及500mL石油醚,回流1h后降温至25℃,过滤,用石油醚-乙酸乙酯(体积比4∶1)洗涤(200mL×3),干燥,得到91.5g产品,收率66.1%,mp217~219℃,
6)恩曲他滨粗品的制备
向反应瓶中加入30mL水、磷酸氢二钾三水合物27.4g(0.12mol·L-1)、150mL无水乙醇,搅拌下加入20g(0.05mol·L-1)缩合物(7)。20~25℃下加入含8.4g吧(0.15mol)硼氢化钾的84mL氢氧化钠(2.5mg·L-1)溶液,60min内加完,继续在(25±2)℃下反应2h。混合液静止,保留有机相,用浓盐酸调pH至4.0~4.5,之后用2mol·L-1氢氧化钠调pH至6.8~7.2,减压蒸馏,收集84mL馏分。用200mL甲苯分两次提取,将水层减压蒸馏至近干,加入无水乙醇150mL,升温至65℃,搅拌溶解物料1h,热过滤除去不溶解的无机盐,减压蒸馏滤液得到恩曲他滨粗品9.9g,收率80.1%。
7)恩曲他滨水杨酸盐一水合物的制备
向固体残余物9.9g(0.04mol)中加入60mL无水乙醇,加热至全溶后过滤,向滤液中加入6.8g(0.049mol)水杨酸和102mL纯化水,升温至50℃,全溶后缓慢冷却至35℃,向溶液中加入FTC水杨酸盐晶种,继续降温至25℃,搅拌2h,冷却至0~5℃,再搅拌2h,抽滤,用冷水70mL洗涤产物,干燥,得到14.6g恩曲他滨水杨酸盐一水合物,收率90.1%。
8)恩曲他滨(emtricitabine)的制备
将78mL无水乙醇、13g恩曲他滨水杨酸盐一水合物、5.58mL三乙胺加入反应瓶中,搅拌升温至46℃,待物料全溶后,加入2.68g活性炭,于60~65℃搅拌1h。趁热过滤,用20mL乙醇洗涤活性炭,滤液减压蒸出78mL乙醇,向残余油状物中加入78mL乙酸乙酯,室温搅拌析晶,继续于25℃及0~5℃分别搅拌1h,过滤,用100mL乙酸乙酯分3次洗涤,干燥,得到白色粉末性状的恩曲他滨7.3g,收率92%,mp184~186℃,[α]25D=-116°(c1.05,MeOH)。
[1] 恩曲他滨的研究现状与应用前景
[2] 恩曲他滨胶囊说明书
[3] 恩曲他滨的合成工艺研究