
手机扫码访问本站

微信咨询
5'-腺苷酸脱氨酶(AMP脱氨酶)能催化一磷酸腺苷(AMP)不可逆水解为一磷酸肌苷(IMP)和氨,是食品工业中的一种重要的酶。本研究筛选出一株新菌,可在32℃下高效产生3191.6U/g的AMP脱氨酶,纯化后,AMP脱氨酶的最适温度和pH分别为40℃和6.0,且会被Fe3+、Cu2+、Al3+和Zn2+部分抑制。通过应用AMP脱氨酶表达系统,添加6mL的粗酶液即可从2.04mg/g的干酵母中获得2.00mg/g的IMP,40min后摩尔产率可达84.8%。这些结果为生产AMP脱氨酶提供了新的见解,也为5'-IMP的生产提供了一个潜在的平台。
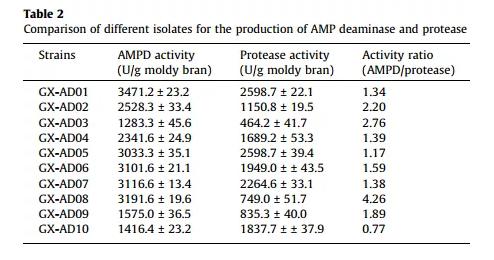
10株菌株能分泌1000.0U/g以上的AMP脱氨酶麸曲,其中产酶活性最高的菌株为GX-AD01,可分泌3471.2u/gAMP脱氨酶麸曲。同时,对胞外蛋白酶的活性进行了研究,发现菌株GX-AD03的蛋白酶活性最低,达到464.2U/g麸曲。不乐观的是,表现出最高AMP脱氨酶活性的菌株GX-AD01也产生了较高的蛋白酶活性,可达2598.7U/g麸曲。因此,根据AMP脱氨酶/蛋白酶的比例,筛选出AMP脱氨酶和蛋白酶活性分别为3191.6和749.0 U/g的麸曲的菌株GX-AD08为本研究AMP脱氨酶的潜在生产菌(表2)。
此外,还对GX-AD08的遗传稳定性进行了研究,在六次重复传代后,其AMP脱氨酶产生能力具有显著稳定性。此外,根据其16S rDNA序列对菌株GX-AD08进行了分类鉴定,与米曲霉3811具有99%的同源性。因此,生理学和系统发育实验表明,菌株GX-AD08属于A. oryzae,被命名为A. oryzae GXAD08。
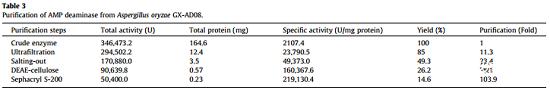
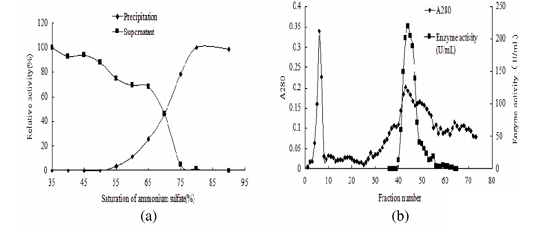
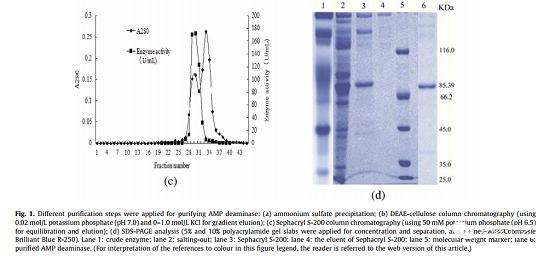
为了获得高纯度的AMP脱氨酶, 通过超滤、硫酸铵沉淀、DEAE纤维素柱层析和sephacryl S-200柱层析对其进行纯化(图1)。结果表明,粗AMP脱氨酶的总活性从346473.2 U显著降低至50400.0 U,而蛋白质产量从164.6 mg显著降低至0.23 mg,但其比活性显著提高103.9倍,达到219130.4 U/mg蛋白质(表3) 。随后,通过SDS-PAGE对纯化的酶进行评估分析,获得了单个蛋白条带,结果表明酶纯度明显提高。为了评估AMP脱氨酶的分子量(MW),测量了标准蛋白质的分子量与其相对迁移距离之间的关系(图S3),然后计算出AMP脱氨酶的分子量为85.39 kDa。
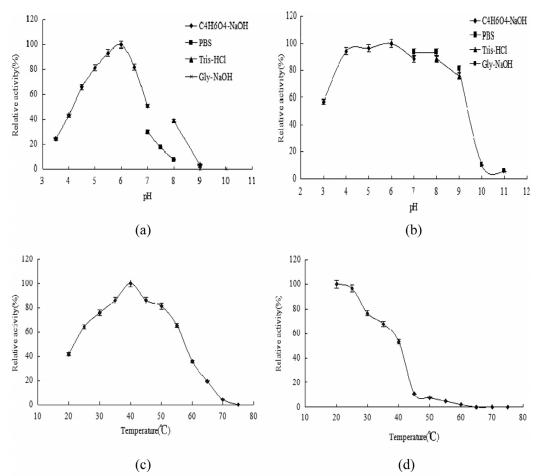
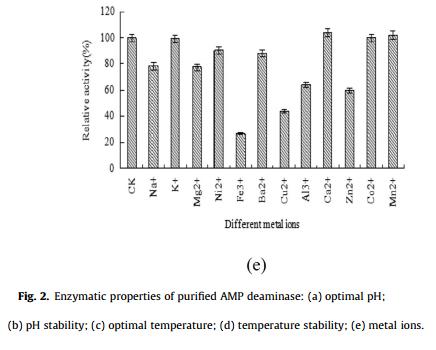
pH 值对纯化 AMP 脱氨酶的酶活性和稳定性的影响如图 2 所示。AMP脱氨酶的最适pH为6.0,在pH值在4.0-6.0范围内时,随着pH值的升高,活性逐渐增强,但随着pH值从6.0进一步升高到10.0,活性显著降低.(图2a)。在4℃下培养6小时后,pH值为4.0-8.0时超过85%的酶具备剩余活性,但该酶在pH值为10.0时完全失活(图2b)。此外,测定纯化AMP脱氨酶的最佳培养温度为40℃(图2c)。然而,热稳定性实验表明AMP脱氨酶在25℃以下保持稳定,但在60℃以上完全失活(图2d)。因此,该酶在菌株A . oryzae GX-AD08的培养温度下是稳定的(32℃)。此外,图2e还研究了不同金属离子对酶活性的影响。结果表明,5mmFe3+和Zn2+可使AMP脱氨酶活性分别显著降低72.7%和59.2%,而5mmCa2+、K+、Co2+和Mn2+对AMP脱氨酶活性无影响。因此,金属离子对AMP脱氨酶活性没有表现出刺激效应,这与以前的报道不一致。测量纯化AMP脱氨酶的Vmax和Km值,分别达到0.138 mM/min/mg和0.223 mM,这与其他天然酶的值相同。以上结果表明来自A. oryzae的AMP脱氨酶具有优良的酶促反应动力学参数,表现出具有生产IMP的巨大潜力。
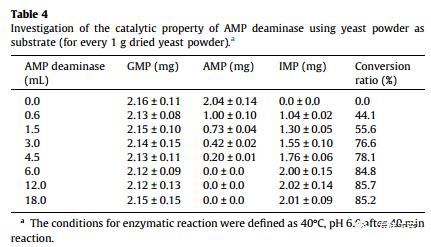
为了进一步评估AMP脱氨酶的工业潜力,采用高效液相色谱法测定了其催化性能。如图S4所示,纯化的AMP脱氨酶能够以足够的特异性有效催化IMP的产生,因此仅获得两个HPLC峰,这表明在与AMP脱氨酶的酶促反应过程中没有副产物产生。另外,当AMP脱氨酶产生系统在30-L固体发酵系统(32°C,pH 6.0,培养基D)中扩增时,以酵母粉为底物研究粗酶的催化能力。如表4所示,随着AMP脱氨酶的加入,AMP的含量逐渐降低,而 IMP的浓度相应增加。例如,当添加6ml的AMP脱氨酶时,AMP(2.04mg/g干酵母)的含量可有效转化为IMP(2.00mg/g干酵母),转化率为84.8%。更重要的是,当加入AMP脱氨酶时,GMP的浓度没有变化,表明来自于A. oryzae GX-AD08的AMP脱氨酶对AMP具有良好的催化能力和催化特异性。
本研究纯化得到了一种来源于米曲霉的AMP脱氨酶,其最适温度和pH值分别为40℃和6.0。当应用AMP脱氨酶表达系统时,粗酶液可以有效催化IMP的合成,转化率达到84.8%。然而,仍存在一些因素会限制AMP脱氨酶的工业化生产,包括其在工业条件下(有机溶剂的存在、高温等)的不稳定性,以及与其它类似蛋白质结合的产物。为此,可将酶固定在载体上,从而提供一种可改善AMP脱氨酶性能的替代途径,包括其稳定性、活性、特异性和选择性。固定化结合基因操作和支持设计等领域的快速发展,蛋白质化学、有机化学、反应器和反应设计应成为改善AMP脱氨酶作为工业生物催化剂的不同特性的日益流行的工具。