
手机扫码访问本站

微信咨询
溶菌酶(英文名称:Lysozyme,又译溶解酶)是一个分子量为14.4kDa的抗菌酶,属于固有免疫系统的一员,它可经由催化细菌细胞壁肽聚糖中的N-乙酰胞壁酸和N-乙酰葡糖胺残基间的1,4-β-糖苷键水解,而破坏细菌的细胞壁。由于革兰氏阳性菌的肽聚糖层远厚于革兰氏阴性菌,且为其细胞壁主成分,此酶主要针对革兰氏阳性菌。
一些人体细胞分泌液中含有溶菌酶在,如唾液、眼泪、鼻涕;溶菌酶也存在于线粒体中的细胞质颗粒体和蛋清中。
1909年Laschtschenko发现蛋清中有杀菌物质。1922年,亚历山大·弗莱明在研究鼻腔粘液的抗菌作用时发现并命名了溶菌酶。[1]
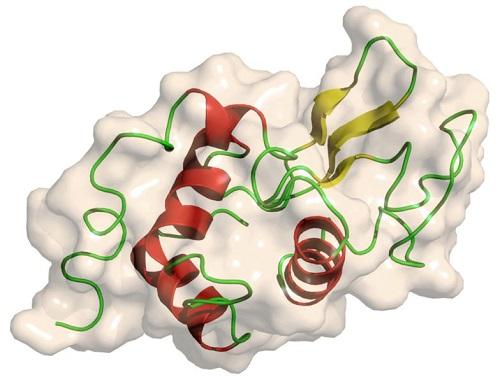
1965年,大卫·菲利浦用X射线衍射技术研究溶菌酶晶体,解析出了2埃分辨率的晶体结构。[2][3]这是第二个使用X射线衍射技术得到的蛋白质结构,也是第一个解析出的酶结构。大卫·菲利浦根据次结构提出了溶菌酶催化的机理,该催化机理最近得到了修正。[4]
溶菌酶是体内免疫系统的一部分,可杀灭革兰氏阳性菌。溶菌酶结合到细菌表面,减少负电荷并协助对细菌的吞噬作用。新生儿缺乏溶菌酶会导致肺支气管发育不良(bronchopulmonary dysplasia)。食用缺乏溶菌酶的配方奶粉会使婴儿腹泻的概率提高三倍。眼泪中缺乏溶菌酶会导致结膜炎。
某些癌细胞会分泌过量的溶菌酶,导致血液中溶菌酶含量过高,造成肾衰竭和低血钾。
溶菌酶进攻肽聚糖(细菌细胞壁的组分,特别在革兰氏阳性菌的细胞壁中含量丰富)水解连接N-乙酰胞壁酸和N-乙酰葡糖胺第四位碳原子的糖苷键。整个过程是,首先溶菌酶通过其两个结构域之间的“沟”结合到肽聚糖分子上;随后其底物在酶中形成过渡态的构象。根据Phillips机制,溶菌酶与葡聚六糖结合。然后溶菌酶将葡聚六糖上的第四个糖扭曲为半椅形构象。在这种扭曲状态(能量较高)中,糖苷键很容易就发生断裂。
位于溶菌酶蛋白序列35位的谷氨酸(Glu35)和52位的天冬氨酸(Asp52)的侧链被发现对于溶菌酶的活性非常关键。Glu35作为糖苷键的质子供体,剪切底物的C-O键;而Asp52作为亲核试剂参与生成糖基酶中间体。随后,糖基酶中间体与水分子发生反应,水解生成产物,而酶保持不变。
在一些遗传性淀粉变性症中发现,病人编码的溶菌酶基因中含有一个突变,从而导致溶菌酶在体内多个组织中聚集。
溶菌酶被广泛用于实验室中对细菌所进行的细胞破碎。
由于溶菌酶易于结晶,常被用于各种晶体学相关的研究。