
手机扫码访问本站

微信咨询
原代细胞是从目标组织或器官分离出来的异质细胞群,包含了多种细胞类型,其中既有终末分化细胞,也包括干细胞、祖细胞以及其他一些仍具有分裂能力的细胞。相关阅读:《什么是原代细胞?一文为您解读》
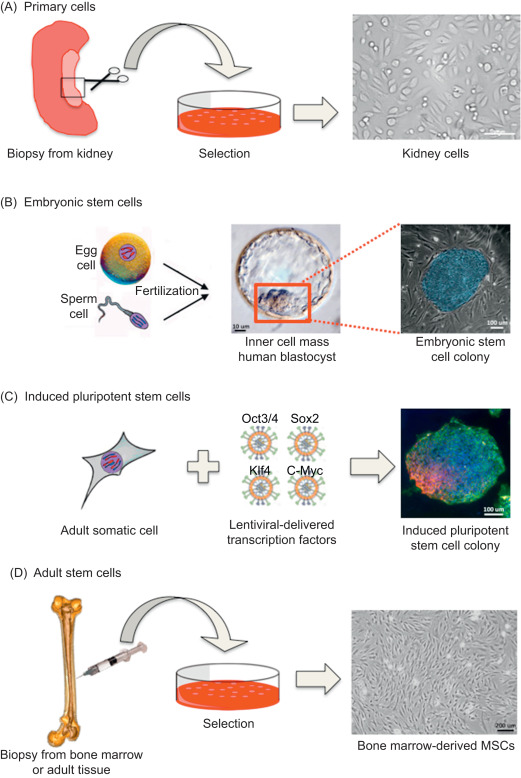
(A)原代细胞直接来自被工程化的组织。(B)自从小鼠胚胎干细胞显示出分化成各种器官类型的潜力以来,胚胎干细胞一直受到研究。(C)成体细胞可以从组织中提取,并通过遗传转录因子诱导成干细胞状态,从而重置细胞的表观遗传组织。(D)每种组织似乎都有驻留干细胞,有助于修复该组织。这些成体干细胞可以被分离并用于形成类似的组织。(图片来源sciencedirect)
原代细胞培养是指从组织中分离出细胞在体外进行早期传代培养(通常在5代以内,更严格的会在3代以内)。通过对原代细胞培养,科研者可以更好研究细胞生命过程、癌细胞病变、细胞工程等问题,因为它提供更接近体内环境细胞模型。
当细胞培养瓶中形成致密单层时,它们基本上已饱和。为了使细胞继续生长并增加数量,必须进行传代(再培养)。悬浮细胞可以直接分瓶,而贴壁细胞需要经过消化后才能分瓶。
材料和试剂
细胞:贴壁细胞
试剂:0.25%胰酶、1640培养基(含10%小牛血清)
仪器和器材:倒置显微镜、培养箱、培养瓶、吸管、废液缸等
操作步骤:
步骤1、吸除培养瓶内的旧培养液。
步骤2、向瓶内加入少许胰蛋白酶和EDTA混合液,以能覆满瓶底为限。
步骤3、将培养瓶置于温箱中2~5分钟,当细胞质回缩,细胞间隙增大后,立即终止消化。
步骤4、吸除消化液,向瓶内注入数毫升Hanks液,轻轻转动培养瓶,把残余消化液冲掉。
注意:加Hanks液冲洗细胞时,动作要轻,以免把已松动的细胞冲掉流失。如用胰蛋白酶液单独消化,吸除胰蛋白酶液后,可不用Hanks液冲洗,直接加入培养液。
步骤5、用吸管吸取营养液轻轻反复吹打瓶壁细胞,使之从瓶壁脱离形成细胞悬液。注意:吹打细胞力度要适中,对一些脆弱细胞,建议使用细胞刮刀轻轻刮下细胞,避免吹打带来损伤。
步骤6、计数板计数后,把细胞悬液分成等份分装入数个培养瓶中,置温箱中培养。
实验注意事项:
1.预热所有试剂: 将胰蛋白酶/EDTA、Hanks液或培养基预热至37℃,可以提高消化效率,并减少对细胞的冷刺激。
2.无菌操作: 所有操作都必须在无菌条件下进行,以防止污染。
3.优化消化时间: 不同的细胞类型对胰蛋白酶/EDTA的敏感性不同,需要根据实际情况调整消化时间。过短的消化时间会导致细胞无法完全脱离瓶壁,而过长的消化时间则会损伤细胞。
试剂:培养基、平衡盐溶液
仪器和器材:离心管、吸管或移液器、新的细胞培养瓶/皿、计数板、冻存管
操作步骤:
步骤1、轻轻混匀细胞悬液:不要剧烈摇晃,以免损伤细胞。可以使用血清移液管轻轻吹打几次,使细胞悬浮均匀。
步骤2、取少量细胞悬液进行计数:使用计数板或自动化细胞计数器对细胞进行计数,确定细胞密度和活力。
步骤3、根据所需的细胞密度和传代比例,计算分装体积:例如,如果需要将细胞密度调整为1x10^5cells/mL,则需要根据细胞计数结果和分装后的总体积计算需要转移的细胞悬液的体积。
步骤4、分装细胞悬液:将计算好的体积的细胞悬液转移到新的培养瓶中,并加入新鲜的培养基至所需的体积。
步骤5、置于培养箱中培养:将分装好的细胞置于37℃、5%CO2的培养箱中进行培养。
步骤1、将细胞连同培养液一并转移到离心管内,离心800-1000rpm,5分钟。
步骤2、去除上清,加新的培养液到离心管内,用吸管吹打使之形成细胞悬液。
步骤3、将细胞悬液分别接种到另外两到三个培养瓶中,置37℃培养箱中培养。
上述 是细胞传代几种步骤,科研者可以成功的进行细胞传代培养,为各种实验和研究提供稳定可靠的细胞来源。
 QQ:2881498722
QQ:2881498722  手机号码:15800441226
手机号码:15800441226 服务电话:021-54721350
服务电话:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室
公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室