
手机扫码访问本站

微信咨询
在所有分子生物学领域中,用于核酸(DNA、RNA)定量的首选方法是实时荧光定量PCR(QuantitativeReal-timePCR,qPCR)。它能实时监测聚合酶链式反应(PCR)扩增DNA的事实。与传统PCR相比,它是一种定量方法,它能够确定样本中扩增DNA的精确量(相对或绝对)。相反,在传统PCR中,扩增的DNA只能在扩增完成后才能检测到(终点检测)。
除了DNA,RNA也可用作模板(例如,在基因表达研究或RNA病毒检测中)。在这种情况下,需要将RNA逆转录为DNA(也称为互补DNA或cDNA),然后使用实时PCR进行扩增。这种组合方法有一个术语:实时逆转录PCR或简称为qRT-PCR(有时称为RT-qPCR)。
PCR是一种利用酶(热稳定DNA聚合酶,最初于20世纪60年代从美国黄石公园热湖中生长的水生栖热菌中分离出来的)循环扩增模板DNA的短片段(扩增子)的方法。在每个循环中,DNA的短片段数量都会翻倍,从而导致目标呈指数级扩增。
在qPCR中,发生的程序完全相同,但有两个主要区别:首先,扩增的DNA是荧光标记的(通常使用基于花菁的荧光染料),其次,扩增过程中释放的荧光量与扩增的DNA量成正比。整个PCR过程(以及所有30至45个循环)都会监测荧光。样本中DNA分子的初始数量越多,PCR循环中荧光增加的速度就越快(图1和2)。也就是说如果样本包含较多靶标,则可以在较早的循环中检测到荧光。可以检测到荧光的循环称为定量循环(简称Cq),是qPCR的基本结果:Cq值越低,意味着靶标的初始拷贝数越高。这是实时PCR提供的定量方法的基本原理。
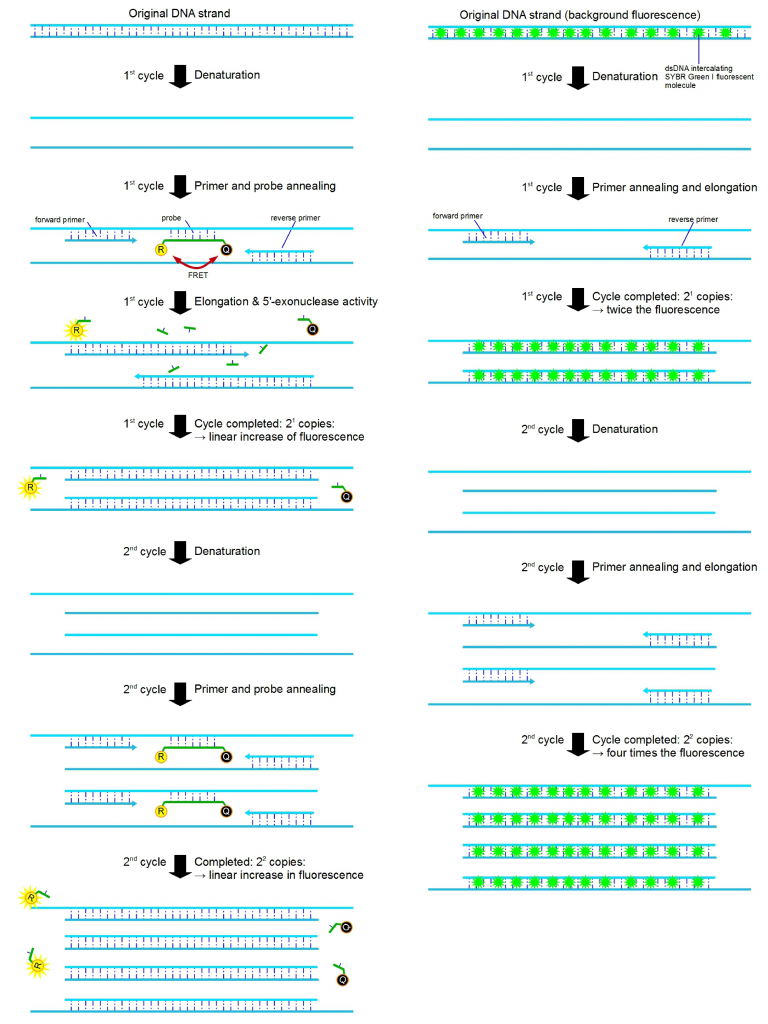
图 1:以图形方式描述了 PCR 管中发生的 qPCR 扩增(前两个循环)。qPCR 信号分子(也称为化学物质)有不同的变体,它们的荧光标记方式略有不同。图中显示了两种最常见的原理。左侧显示的是使用 FRET 机制(荧光共振能量转移)的 5′-核酸外切酶变体,其中报告荧光团 (R) 的荧光被转移到猝灭剂 (Q),并且当报告分子和猝灭剂分子接近时不会发射荧光(例如 TaqMan)。当两者错位时(当探针在 PCR 延伸过程中被 TaqDNA 聚合酶的 5′-核酸外切酶活性移除时),报告分子会自由发射荧光,然后可以检测到。右侧显示的是使用插入荧光团的 qPCR 变体(例如 SYBR Green)。使用特殊的插入染料,当它们插入 dsDNA 中时,荧光发射会大大增加。
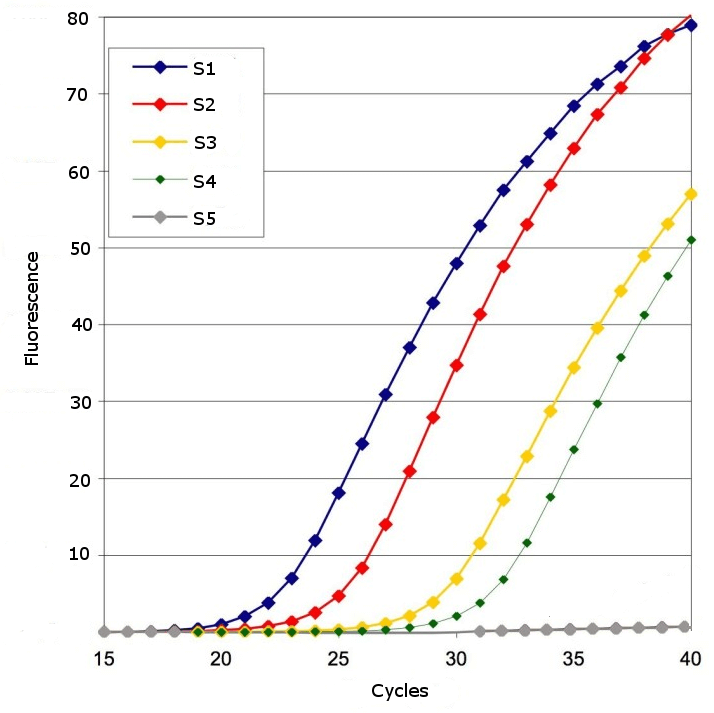
图 2:显示包含五个样本(S1 至 S5)的扩增图。每个样本中的 DNA 在每个循环中都被扩增,荧光随之增加。在上面的例子中,样本 S1 包含的初始目标 DNA 数量最多,因此荧光增加最快。样本 S4 包含的初始目标 DNA 分子数量最少,而 S5 则不包含任何目标 DNA 分子。
有几种方法可以获得Cq值(Cq调用)、我们应该定期检查的扩增曲线参数、将Cq值转换为基因表达的绝对或相对拷贝数的方法等。一旦掌握了这些技能,qPCR就会成为您研究中真正强大的技术。
扩增的DNA有多种荧光标记方法(也称为“qPCR化学方法”),但我们在此不作详细讨论。它们都有一个共同点:在PCR反应过程中产生荧光信号,该信号是可量化的,并且与DNA的起始量成正比。
优于传统PCR:
1.速度:扩增的DNA在PCR反应的同时进行检测,因此无需像传统PCR那样在反应后进行单独检测(例如在琼脂糖凝胶上)。
2.通量:qPCR被认为是一种高通量方法(在短时间内处理大量样品),因为它与用于样品制备的液体处理自动化站兼容(DNA/RNA分离和加载到qPCR板上)。
3.灵敏度:qPCR可以区分2倍大小的目标DNA分子,甚至可以检测到少量的起始DNA分子,与PCR相比,使用量仅为1/1000。
4.定量范围:可进行几个数量级的广泛定量(动态范围高达107倍)。
5.可重复性:一般认为具有高度可重复性。
qPCR的缺点:
1.设备成本:由于敏感荧光检测所需的光学元件,qPCR循环仪比传统PCR热循环仪贵五到十倍。
2.化学品和耗材成本:qPCR是一种非常灵敏的方法,因此,反应混合物的精确成分和高质量极其重要。这就是为什么通常购买即用型反应混合物(主混合物)的原因。由于检测方法(荧光)灵敏,因此需要一套特定的塑料器皿。
3.上样时间:与传统PCR相比,将qPCR样品上样到板中通常是一个更加精确和繁琐的过程,这主要是因为使用的试剂和样品数量更多,而且该方法的灵敏度极高。但是,如果使用PlatR等移液辅助器,上样时间可以大大缩短。
4.PCR反应抑制:由于生物样本的复杂性,核酸分离过程中不完善的纯化过程可能会在分离的样本中留下各种物质的痕迹。PCR反应有时会被这些物质抑制,也称为PCR反应抑制剂(DNA聚合酶易受某些抑制其活性的化合物的影响)。这会使定量过程复杂化。
5.误差敏感性:qPCR是一种极其敏感的方法,因此很容易出错。这意味着即使是最轻微的错误也会对最终结果产生重大影响。最易变和最关键的一点是样品的制备(DNA提取和逆转录)。这就是为什么在进行测定时需要包括几个控制反应(例如无模板控制、缓冲液控制)以确保每次运行的质量控制检查。
6.数据分析:数据分析和结果解释比传统PCR更复杂,但结果更具信息量。
由于其强大的优势,qPCR的应用范围非常广泛。该方法已经存在了很长时间,研究界已经证明了它的可靠性和稳健性。同样,qPCR循环仪制造商开发了可靠的平台,液体处理自动化设备供应商开发了与qPCR兼容的自动化解决方案(例如机器人)。
最明显的是qPCR在分子诊断中的应用,它正在慢慢取代传统方法。它用于检测、鉴定和量化导致疾病的微生物(细菌、病毒和真菌)。使用qPCR可以减少手工劳动,同时还可以减少对污染和错误结果的担忧。它还可以在更短的时间内处理大量样本(每次运行最多384个甚至1536个反应),因此已被证明是诊断实验室中不可替代的方法。但必须注意的是,该方法仅检测微生物DNA或RNA的存在,而不会报告其活力。因此,有时仍需要同时使用传统的微生物技术。
qPCR还用于检测和量化转基因生物或进行基因分型。后者意味着可以检测同一基因的不同等位基因或单核苷酸多态性(SNP),这些可用作某些疾病的遗传诊断或预后标记。
基因表达研究是非常重要的应用领域,它帮助我们了解生物学、微生物学、医学和其他生命科学等各个领域的生物过程。一种非常有用、几乎轰动一时的组合是使用DNA微阵列进行全基因组基因表达筛选,然后使用qPCR验证结果。DNA微阵列本身就是一种非常有效的方法,但它们的灵敏度较低,仍然需要验证。
 QQ:2881498722
QQ:2881498722  手机号码:15800441226
手机号码:15800441226 服务电话:021-54721350
服务电话:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室
公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室