
手机扫码访问本站

微信咨询
抗体于1890年由EmilvonBehring和ShibasaburoKitasato两位科学家首次提出了抗体概念。抗体也称为“免疫球蛋白(lg),”是一种大型Y型蛋白,免疫系统利用其识别和中和外来的抗原,例如细菌和病毒等。抗体能够以极高的特异性和亲和力几乎结合任何非自身的表面。这种属性使抗体不仅是免疫关键,也是生物学研究、疾病诊断和治疗不可或缺的工具。
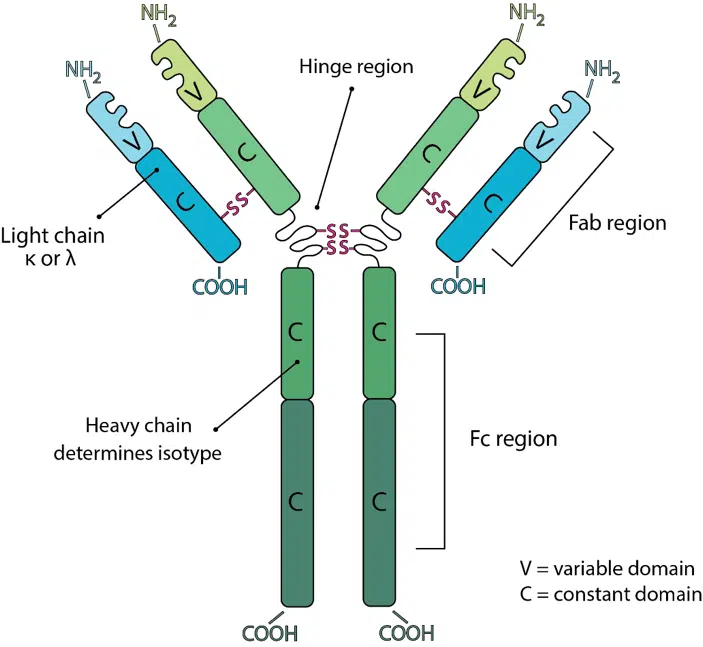
抗体由两条重链和两条轻链组成。根据多肽序列的细微差异,轻链可分为kappa(κ)链或lambda(λ)链。重链定义抗体的类别或同种型。每条组成链包含一个NH2末端可变结构域和一个或多个COOH末端恒定结构域。每个可变结构域或恒定结构域由大约110-130个氨基酸组成。两条轻链仅包含一个恒定结构域,而重链包含三个或四个恒定结构域,这决定了同种型。具有三个恒定结构域的重链往往在第一和第二个恒定结构域之间包含一个间隔铰链区。典型的轻链质量约为25kDa,而带有铰链的三个恒定结构域重链质量约为55kDa。
抗体可分为同种型,同种型由重链恒定区的不同类型定义,每种同种型由单独的恒定区基因编码。不同同种型之间重链恒定区的差异包括链间二硫键的数量和位置、附着的寡糖部分的数量、恒定区的数量和铰链区的长度。在哺乳动物中,抗体分为五种同种型:IgG、IgM、IgA、IgD和IgE。在人类和小鼠中,免疫球蛋白IgG进一步分为亚类(例如小鼠IgG1、IgG2a、IgG2b、IgG2c和IgG3),基于二硫键数量和铰链区长度和柔韧性的细微差异。各种抗体同种型在生物学特征、结构、靶标特异性和分布方面有所不同。
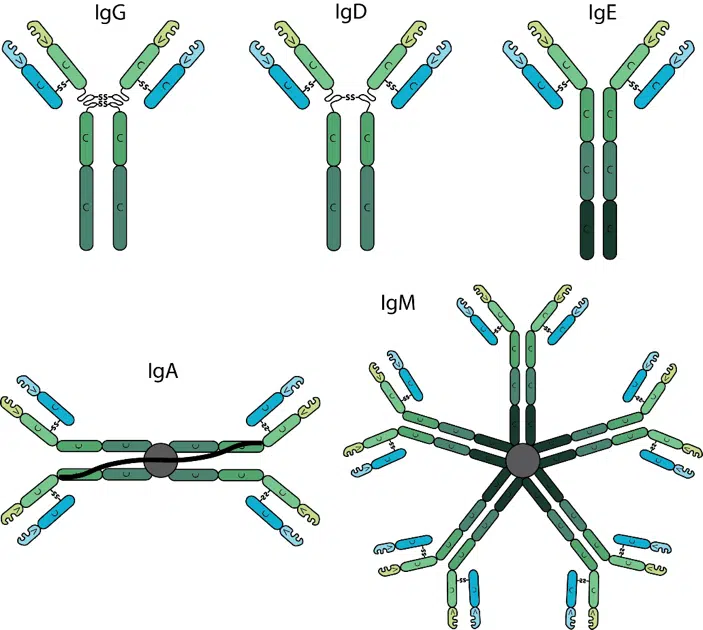
免疫球蛋白G
人体中最主要的同种型是IgG。它是所有免疫球蛋白同种型中血清半衰期最长的。根据重链恒定区的结构、抗原和功能差异,IgG进一步细分为四个亚类。IgG亚类表现出不同的功能活性。例如,IgG1和IgG3抗体通常是对蛋白质抗原的反应而诱导的,而IgG2和IgG4与多糖抗原相关。
免疫球蛋白D
循环IgD在血清中的含量极低,且血清半衰期较短。IgD的功能尚不清楚。
免疫球蛋白E
IgE的血清水平最低,且在所有抗体同型中半衰期最短。IgE与超敏反应和过敏反应以及对寄生虫感染的反应有关。
免疫球蛋白A
IgA血清水平往往高于IgM,但远低于IgG。IgA通常以单体形式存在于血清中,但它可以形成二聚体,其中第三恒定区通过二硫键与多肽链J链结合。IgA还含有分泌成分。分泌成分通过二硫键与二聚体的第二恒定区结合。IgA通过直接中和或防止与粘膜表面结合,在抵御毒素、病毒和细菌方面发挥着重要作用。
免疫球蛋白M
免疫反应过程中产生的第一种抗体是IgM。在成熟和抗原刺激后,IgM单元通过第四恒定区中的二硫键相互连接,形成五聚体IgM。五聚体IgM还包含J链,该链通过二硫键与两个单体结合。通常,单体IgM分子由于未成熟而具有较低的亲和力,然而,五聚体IgM可以通过五聚体抗体和抗原之间的多聚体相互作用实现高亲和力,特别是当抗原包含多个重复表位时。
所有抗体均含有两个F(ab)区和一个Fc区。F(ab)区对应于抗体分子的两个相同臂,其中包含与重链的可变结构域和第一个恒定结构域配对的完整轻链。Fc区对应于重链的恒定结构域,不包括第一个恒定结构域。这三个区域通常称为片段,可以通过蛋白水解酶消化分离。用木瓜蛋白酶消化将抗体切割成三个片段,两个F(ab)片段和一个Fc片段,而胃蛋白酶不会分离两个F(ab)片段,从而产生一个Fc片段和一个F(ab')2片段,由通过二硫键连接的两个F(ab)片段组成。F(ab)和F(ab')2片段即使在消化后仍保留结合抗原的能力,使其成为某些免疫化学技术和实验应用的理想选择。
 QQ:2881498722
QQ:2881498722  手机号码:15800441226
手机号码:15800441226 服务电话:021-54721350
服务电话:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室
公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室